Legge di azione di massa
1) Quando una reazione chimica è completa:
Quando praticamente tutto il reagente è scomparso per dar luogo al prodotto della reazione stessa.
2) Che rapporto c´è tra l´energia libera DG e l´equilibrio di una reazione chimica:
Indipendentemente dalla situazione iniziale il sistema tende sempre spontaneamente a portarsi alla stessa composizione di equilibrio, cui corrisponde il valore minimo della energia libera.
3) Quanto vale DG per una reazione in equilibrio:
Vale 0 come per tutti i processi in equilibrio.
4) Enunciare la legge di azione di massa:
Quando una reazione a temperatura costante raggiunge l´equilibrio, viene definita una costante termodinamica di equilibrio che in pratica rappresenta la resa della reazione, ossia il rapporto tra prodotti e reagenti una volta che la reazione si è arrestata.
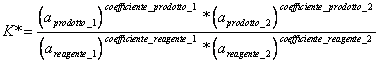
dove a è la attività della sostanza corrispondente alla concentrazione ideale.
* per i gas ideali a = pressione
* per i gas non ideali a = f * p dove f è il coefficiente di attività
* per solidi e liquidi puri la attività è unitaria.
* per una soluzione ideale a = concentrazione.
* per una soluzione non ideale a = f * c dove f è il coefficiente di attività.
5) Enunciare la costante di equilibrio in base alla concentrazione :
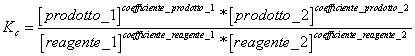
essa viene utilizzata nelle reazioni che hanno luogo in fase gassosa e per le reazioni in soluzione.
6) In quale occasione K* e Kc coincidono:
In tutti quei casi in cui la attività coincide con la concentrazione, come ad esempio per i gas che seguono il comportamento ideale ( a bassa pressione) e per le soluzioni molto diluite. È da notare che solo K* è rigorosamente costante ad ogni temperatura ed insensibile a variazioni di pressione dei reagenti e prodotti.
7) Quale costante di equilibrio viene utilizzata nelle reazioni che interessano aeriformi:
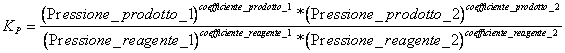
Naturalmente debbono essere prese in considerazione solo le sostanze che nella reazione si presentano allo stato gassoso.
8) Quale relazione lega Kc e Kp :
Kp = Kc (RT)Dn dove Dn è la differenza tra il n° di moli dei prodotti ed il n° di moli dei reagenti
Si ottiene osservando che c = massa/volume = n/V e per un gas = Pparziale / RT , sostituendo nella Kc si ottiene l´esito.
In questo caso R vale 0.0821 (l *Atm / mole * K)
9) Enunciare la costante di equilibrio in termini di frazioni molari :
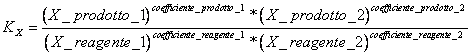
essa viene utilizzata nelle reazioni che hanno luogo in fase gassosa e per le reazioni in soluzione.
10) Quale relazione lega KX e KP :
KP = KX *(PTOTALE )Dn dove Dn è la differenza tra il n° di moli dei prodotti ed il n° di moli dei reagenti
11) In che occasione KP , KC , KX coincidono :
Quando la reazione avviene senza cambiamento del n° di moli delle sostanze gassose.
12) Che relazione c´è tra le costanti di equilibrio e la resa di una reazione :
a) se k >> 1 allora la reazione ha l´equilibrio spostato a destra ossia verso i prodotti.
b) se k << 1 allora la reazione ha l´equilibrio spostato a sinistra ossia verso i reagenti.
13) Quanto vale la costante di equilibrio per la reazione inversa a quella considerata:
È il reciproco della costante di equiibrio calcolata per la reazione diretta.
14) Quanto vale la costante di equilibrio se si moltiplica la reazione per n:
La nuova costante di equilibrio è pari alla vecchia costante elevata alla potenza n-esima.
15) Quanto vale la costante di equilibrio per la reazione somma di 2 reazioni:
È il prodotto delle costanti delle 2 reazioni sommate.
16) Enunciare la costante di equilibrio in funzione della variazione di energia libera mediante la relazione isoterma di Van´t Hoff :
DG° = - R T ln K
dove K può essere una qualsiasi delle costanti di equilibrio in quanto la relazione vale soltanto a pressione ed a temperatura costante. R risulta pari a 1,98 cal / (K*mole) e DG° risulterà espresso in cal / mole pertanto se le moli interessate sono più d´una occorrerà moltiplicare DG° per il loro numero solo in tal modo potremo sapere la variazione di energia libera determinata dalla reazione.
17) Quanto vale DG° per la reazione : 2 NOCl « 2 NO + Cl2 :
DG° = 2G°f (NO) + G°f (Cl2) - 2G°f (NOCl) ed essendo G°f (elemento nel suo stato standard) = 0 allora
DG° = 2G°f (NO) - 2G°f (NOCl)
18) Descrivere la relazione isocora di Van´t Hoff in forma differenziale che lega la costante di equilibrio alla temperatura:
![]()
si osserva:
a) se DH0 < 0 la reazione è esotermica e la costante di equilibrio decresce al crescere della temperatura.
b) se DH0 = 0 la reazione è termoneutrale e la costante di equilibrio è indipendente dalla temperatura.
c) se DH0 > 0 la reazione è endotermica e la costante di equilibrio cresce al crescere della temperatura.
19) Descrivere la relazione isocora di Van´t Hoff in forma integrale che lega la costante di equilibrio alla temperatura:
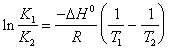
In essa R risulta pari a 1,98 cal / (K*mole) e DH° risulterà espresso in cal / mole.
Da notare che questa espressione è valida solo considerando piccoli intervalli di temperatura , nel qual caso DH0 può essere considerata costante
20) Come si trasforma la isocora integrale di Van´t Hoff per equilibri tra fasi di un sistema ad un solo componente:
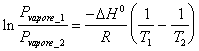
Questo perchè nei sistemi ad un solo componente Kp è pari alla sola tensione di vapore in quanto per il liquido la attività è unitaria. Analogamente per Kc .
21) Quanto vale DH° per la reazione : 2 NOCl « 2 NO + Cl2 :
DH° = « 2H°f (NO) + H°f (Cl2) - 2H°f (NOCl) ed essendo H°f (elemento nel suo stato standard) = 0 allora
DH° = « 2H°f (NO) - 2H°f (NOCl)
22) Enunciare il principio di Le Chatelier o della equilibrio mobile :
Quando si provoca dall´esterno una alterazione delle variabili ( P , T , concentrazione ) di un sistema in equilibrio, l´equilibrio si sposta in un senso che si oppone alla variazione apportata, tendendo a minimizzare gli effetti.
23) Cosa accade se si cerca di aumentare la concentrazione di un elemento nella reazione:
La costante di equilibrio deve rimanere costante e pertanto se aumenta la concentrazione di una sostanza, le altre sostanze della reazione muteranno la loro concentrazione in modo da far si che Kc rimanga costante, ciò vuol dire che il sistema reagisce in modo da consumare l´eccesso di composto.
24) Quale effetto ha una variazione della pressione esterna su di un sistema in equilibrio:
Dipende dal tipo di reazione , ad esempio nella reazione N2 + 3H2 « 2NH3 se la reazione procede verso dx , il n° di moli diminuisce, pertanto se ad esempio viene aumentata la pressione esterna su questo sistema in equilibrio, esso cercherà di rispondere in modo da annullare questo aumento di pressione, il che si ottiene spostando l´equilibrio verso il n° minore di moli, cioè rimarrà piccola parte di reagenti in quanto quasi completamente trasformati in prodotti della reazione.
25) Quando una trasformazione chimica si dice omogenea e quando eterogenea:
Quando sia reattivi che prodotti sono presenti in una fase unica, eterogenea se le sostanze in equilibrio chimico sono presenti in 2 o più fasi.
26) Come vengono influenzate le dissociazioni gassose da pressione e temperatura:
Esse debbono essere espresse in termini del grado di dissociazione a, il quale dovrà cambiare in modo da bilanciare quelli che sono i cambiamenti di pressione o di temperatura, basta del resto osservare che la dissociazione è una reazione che avviene con aumento del n° di moli e pertanto essa è favorita da una diminuizione della pressione esterna.
Si osserva inoltre che essendo la dissociazione caratterizzata da rottura di legami, essa non può che essere endotermica, cioè con acquisto di calore dalla ambiente e pertanto è favorita da un aumento di temperatura.
27) Enunciare in termini di a le moli per la reazione : 2 NOCl « 2 NO + Cl2 :
2 NOCl « 2 NO + Cl2
n0(1 - a) ( n0a ) (n0a) / 2
eventuali altre moli che fossero presenti per i prodotti di reazione, vanno sommate ai termini già presenti. Se fossero presenti altri reagenti, la reazione non si potrebbe scrivere in termini di a in quanto si ignorerebbe il contributo sui prodotti. La dissociazione ha dunque senso solo per queste reazioni dove un composto si scinde in 2 o più componenti.
28) Enunciare in termini di moli dissociate la reazione : 2 NOCl « 2 NO + Cl2 :
2 NOCl « 2 NO + Cl2
n0(NOCl) - 2x n0(NO) + 2x n0(Cl2) + x
29) Come valutare se una data reazione è in equilibrio e, se non lo è, in quale senso decorre spontaneamente:
Si calcola la DG = DG° + RT ln Q . Si possono presentare i seguenti casi :
DG = 0 Þ in tal caso la reazione è in equilibrio.
DG < 0 Þ la reazione decorre spontaneamente da sx verso dx.
DG > 0 Þ la reazione decorre spontaneamente da dx verso sx.
In quest´ultimo caso un eventuale calcolo delle moli prevede che le moli che diminuiscono rispetto alla situazione iniziale sono quelle dei componenti che si trovino a dx nella reazione, mentre i componenti a sx aumentano il n° di moli.
30) In equilibri in cui compaiono solidi e gas, quale è l´importanza delle moli del solido:
Le moli del solido che si consumano sono in rapporto stechiometrico esatto con i valori delle moli che si creano le quali debbono però essere ricavate tramite le costanti d´equilibrio. Ad esempio nel calcolo delle moli totali per la Kc , vanno considerate solo le moli dei gas.
31) Come vengono influenzate gli equilibri dei sistemi solidi e liquidi da modifiche della pressione o della temperatura:
La pressione ha effetti minimi in quanto in queste reazioni sono scarse le variazioni di volume.
32) Come si può velocizzare una reazione:
Se essa è reversibile si deve allontanare i prodotti di reazione man mano che si formano, in tal modo il processo avviene in maniera pressochè completa.
33) Come vengono influenzati gli equilibri eterogenei da variazioni di pressione o di temperatura:
Vi sono reazioni per le quali essendo presenti liquidi, solidi e gas, è immediato capire in quale senso la reazione si svolga con aumento di volume, la reazione risulterà stimolata in tal senso se diminuisce la pressione esterna.
È intuitivo ad esempio pensare che se si aumenta la pressione, il sistema-reazione cercherà di diminuire la sua pressione e quindi l´equilibrio si sposterà in modo da sfavorire la creazione di gas rispetto a liquidi o solidi.
34) Che particolarità ha l´equilibrio NH4HS(S) « NH3 (S) + H2S(G)
Il reagente si trova allo stato solido pertanto non compare ne nella KC che nella KP nè in alcun eventuale calcolo delle moli tramite la PV = n RT , che ha senso solo per i componenti allo stato gassoso.
35) Per l´equilibrio SnO2 + 2 H2(G) « Sn(S) + 2 H2O(G) come si possono ottenere 5 moli di Sn :
Nota la 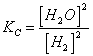 si deve far sì che [ H2 ] sia tale che le moli di H2 siano 10 cioè il doppio delle moli di stagno.
si deve far sì che [ H2 ] sia tale che le moli di H2 siano 10 cioè il doppio delle moli di stagno.
36) Per l´equilibrio C(S) + H2O(G) « CO(G) + H2 (G) quanta acqua mi occorre per gasare 1,1 moli di C(S) :
Debbono crearsi 1,1 moli di CO ed 1,1 moli di O2 , affinché ciò avvenga si dve desumere le moli all´equilibrio dalla KP ed a queste aggiungere 1,1.
37) Perchè se lasci aperta la acqua minerale questa si sgasa :
Se la bottiglia è chiusa c´è della CO2 tra acqua e tappo che ha una determinata pressione, se noi apriamo la bottiglia, questa CO2 esce e la pressione alla quale è sottoposta la soluzione è molto più bassa, pertanto si produrrà CO2 sotto forma di bollicine che salgono in superficie, nel vano tentativo da parte della soluzione di rispondere a questa variazione del sistema così finisce che nel giro di 10 minuti la acqua si sgasa completamente.