Soluzioni
1) Cosa è una soluzione :
È un sistema omogeneo formato da 2 o più componenti i quali si trovano dispersi nel sistema sotto forma di molecole o ioni. E´ fondamentale che le particelle abbiano dimensioni molecolari, altrimenti si parla di stato colloidale.
2) Vi possono essere legami chimici tra le sostanze presenti nella soluzione:
No, altrimenti si tratterebbe di un nuovo composto. Deve quindi essere possibile riottenere dalla soluzione le sostanze componenti mediante procedimenti fisici di separazione.
3) Cosa individua e cosa è la concentrazione di una soluzione:
Individua la composizione e si definisce come la quantità di ogni componente presente in una data massa o volume di soluzione.
4) Che unità di misura ha la concentrazione:
Riferite al peso :
per cento in peso Þ g di soluto in 100g di soluzione
molalità m Þ n° moli di soluto in 1000g di solvente
Frazione molare x Þ n° moli del componente / n° moli totali della soluzione
Riferite al volume :
Per cento in volume Þ g di soluto in 100 ml di soluzione
Molarità M Þ n° di moli di soluto in 1000ml di soluzione
Normalità N Þ n° di equivalenti di soluto in 1000ml di soluzione
![]()
Per cento in volume Þ ml di soluto in 100ml di soluzione. il volume totale della soluzione non è pari alla somma dei volumi dei 2 componenti ma inferiore .
5) Che rapporto c´è tra Normalità e Molarità:
![]() dove a è un intero che vale 1 per acidi monoprotici, 2 per acidi diprotici... e così via.
dove a è un intero che vale 1 per acidi monoprotici, 2 per acidi diprotici... e così via.
È lo stesso coefficiente che lega PM e Peq.
6) Quando una soluzione è satura:
Quando in essa il soluto indisciolto è in equilibrio con il soluto disciolto.
7) Quando una soluzione è soprasatura, e sua stabilità:
Una soluzione è soprasatura quando per essa si raggiunge una concentrazione di soluto superiore alla concentrazione corrispondente alla soluzione satura. Non è stabile, tende sempre a raggiungere la concentrazione della soluzione satura.
8) Cosa è la solubilità:
Per una determinata sostanza in un dato solvente ad una data temperatura la solubilità corrisponde alla concentrazione della soluzione satura a quella temperatura, ossia a quanto soluto si trova disciolto nel solvente per quella particolare soluzione nella quale non può disciogliersi ulteriormente il solvente.
9) Cosa è il prodotto di solubilità:
È semplicemente la legge di azione di massa riferita alla reazione di ionizzazione del soluto KS = [A+][B-] / [AB] e siccome non si dovrebbe parlare di concentrazioni ma di attività, ne consegue che [AB] deve essere unitaria e dunque
KS = [A+][B-] = costante.
10) Quanto vale la solubilità del sale Pb(IO3)2 sciolto in acqua:
Pb(IO3)2 si ionizza in Pb2+ avente concentrazione s e 2IO3- avente concentrazione 2s.
Ks = [Pb2+][IO3-]2 = s * (2 s)2 = 4 s3
11) Quale è la condizione affinchè si formi del precipitato:
In un dato istante il prodotto [A+][B-] deve essere > del Ks, il quale dovendo essere costante impone che la reazione si sposti verso il soluto allo stato solido.
12) Descrivere l´effetto dello ione comune :
La solubilità di un soluto in acqua pura è più elevata rispetto al caso in cui lo stesso soluto è disciolto in una soluzione acquosa contenente un suo ione. Per calcolarla occorre considerare nel prodotto di solubilità che la concentrazione dello ione in questione è più elevata mentre Ks deve rimanere costante quindi nel complesso si creerà meno quntità dello ione non comune il che equivale a dire che si scioglie meno soluto.
13) Se ho un soluto sul fondo di una soluzione, quale è la condizione affinchè si sciolga tutto:
Deve essere la solubilità pari al rapporto tra il n° di moli ed il volume della soluzione, infatti la solubilità è la concentrazione della soluzione in cui è sciolto il soluto.
14) Come calcolare la concentrazione degli ioni nella soluzione quando uno dei 2 è in forte eccesso rispetto alla altro:
Si deve considerare che lo ione presente con minore concentrazione precipita tutto se [A+][B-] > Ks , la concentrazione dello ione in eccesso si ottiene sottraendo la quantità della altro ione che precipita mentre la quantità della altro ione che rimane in soluzione si ricava dalla Ks. In pratica occorre tener presente l´effetto dello ione comune.
15) Come calcolare la concentrazione degli ioni in soluzione quando sono nell´esatto rapporto stechiometrico:
Si può considerare la soluzione trascurando l´effetto dello ione comune e considerando quindi come un sale disciolto in acqua pura.
16) Cosa si intende per precipitazione frazionata:
Si intende la situazione per la quale uno stesso ione può determinare la precipitazione di 2 diversi soluti, in tal caso, il 1° a precipitare è quello per il quale è richiesta una minore concentrazione di questo ione comune.
17) Cosa è il coefficiente di ripartizione:
Quando un soluto è posto a contatto con 2 solventi non miscibili, si ripartisce tra di essi formando 2 distinte soluzioni. Il coefficiente di ripartizione esprime appunto che il rapporto tra la concentrazione del soluto nel solvente A e la concentrazione del soluto nel solvente B è costante. 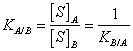
![]()
18) Quanti grammi di solvente rimangono in soluzione a seguito della estrazione con V litri di solvente:
![]()
19) Come si può estrarre dal solvente una quantità di soluto maggiore, utilizzando meno litri del secondo solvente che non nel caso della domanda precedente:
Si può effettuare l´estrazione più volte consecutivamente con quantità uguali del 2° solvente, in tal caso
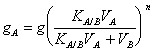
20) Enunciare la legge di Henry sulla solubilità dei gas nei liquidi :
Essa afferma che la solubilità di un gas in un liquido è proporzionale alla pressione parziale del gas in equilibrio con la soluzione, a patto che il gas non reagisca con essa.
21) Cosa è il coefficiente di solubilità:
Esprime quanto gas si scioglie in un volume di liquido ed è indipendente dalla pressione ![]() .
.
22) Cosa è il coefficiente di assorbimento:
Esprime quanto gas si scioglie nel volume unitario alla temperatura t quando la pressione del gas in equilibrio con la soluzione è pari ad 1 atm ![]() dove VG0 è il volume riportato alle condizioni di temperatura di 1 Atm e di 0 K tramite la
dove VG0 è il volume riportato alle condizioni di temperatura di 1 Atm e di 0 K tramite la ![]() .
.
23) Che relazione c´è tra il coefficiente di assorbimento a ed il coefficiente di solubilità b :
![]() dove T0 = 273K
dove T0 = 273K
24) In che modo la natura del solvente e del soluto agiscono sulla solubilità:
Si deve analizzare il processo da un punto di vista termodinamico in 3 fasi :
a) Vengono separate le molecole di soluto(endotermico).
b) Vengono separate le molecole di solvente(endotermico).
c) Vengono formati legami tra molecole di soluto e di solvente(esotermico)
Il bilancio energetico di queste 3 fasi implica la differente solubilità, in particolare un dato soluto si scioglie nei solventi le cui molecole sono tenute unite dallo stesso tipo di legami intermolecolari(forze di van der Waals e momenti dipolari ) presenti nel soluto puro.
25) Cosa è la entalpia di soluzione e a cosa serve:
È la variazione di entalpia (H = Energia interna + PV) associata al processo di creazione della soluzione. Essa è utile per determinare se la solubilità di quella data soluzione aumenta o diminuisce con la temperatura, nella fattispecie, la temperatura aumenta se il processo è endotermico ( H > 0 ), diminuisce se il processo è esotermico ( H < 0 ).
26) Che effetto ha la pressione sulla solubilità:
Aumentando la pressione diminuisce il volume e pertanto aumenta la concentrazione e conseguentemente la solubilità.
27) A cosa serve e che caratteristiche ha una soluzione ideale:
Serve a studiare i numerosi fenomeni che interessano il processo di soluzione. Le sue caratteristiche sono :
a) Il volume della soluzione è pari alla somma dei volumi dei componenti.
b) La formazione della soluzione a partire dai componenti non è accompagnata da sviluppo o assorbimento di calore.
28) Cosa sono e quali sono le proprietà colligative delle soluzioni ideali:
Sono proprietà che dipendono unicamente dal numero di particelle di soluto contenuto nell´unità di volume di soluzione e quindi completamente indipendenti dalle proprietà chimiche dei componenti. Esse sono :
a) Quando nel liquido viene disciolto un soluto, la tensione di vapore viene modificata.
b) Abbassamento crioscopico
c) Innalzamento ebulloscopico.
d) Pressione osmotica.
29) Cosa è la tensione di vapore e come viene modificata a seguito della introduzione del soluto nel solvente:
La tensione di vapore è la pressione per la quale il liquido è in equilibrio con il suo vapore ad una determinata temperatura, indica cioè proprio la pressione che compete al vapore, ricordando che un liquido coesiste con il suo vapore nel corso di un passaggio di stato, trasformazione per la quale la pressione rimane costante per una data temperatura.
Se inserisco un solvente non solubile, esso non si distacca quindi ad una data temperatura si ha l´equilibrio per una pressione e quindi tensione di vapore più bassa.
30) Enunciare la legge di Raoult :
L´abbassamento relativo della tensione di vapore del solvente è uguale alla frazione molare del soluto
![]() valida solo se il soluto è una sostanza non volatile. Lo stesso concetto in altre parole :
valida solo se il soluto è una sostanza non volatile. Lo stesso concetto in altre parole :
La tensione di vapore di una soluzione ideale data dai componenti A e B è pari alla somma dei prodotti delle tensioni di vapore dei singoli componenti allo stato puro per la rispettiva frazione molare nella soluzione.
P = P0A * XA + P0B * XB
Se la tensione di vapore di un soluto, ad esempio B, è trascurabile alla temperatura considerata allora
P = P0A * XA
31) Nel calcolo della abbassamento della tensione di vapore come si tiene conto del grado di dissociazione:
![]()
32) come si calcola la composizione della fase vapore in frazioni molari:
Per il singolo componente è il rapporto tra la sua pressione di vapore nella miscela e la pressione di vapore totale della miscela stessa.
33) Se ho una miscela liquida in equilibrio con il suo vapore, quali relazioni legano le 2 fasi:
a) la pressione di vapore del singolo componente nel vapore è pari alla tensione di vapore del componente allo stato puro per la sua frazione molare.
b) Il n° di moli del singolo componente nel vapore si può ricavare dalla PV = nRT considerando la pressione che compete al singolo elemento e che è ricavata nel punto a) .
34) Cosa è il punto di gelo o di fusione:
È la temperatura alla quale le tensioni di vapore del liquido e del solido hanno lo stesso valore.
Abbiamo visto che la tensione di vapore della soluzione è inferiore alla tensione di vapore del solvente allo stato puro e pertanto se questa tensione di vapore decresce, mentre rimane costante la tensione di vapore del solido allora l´equilibrio tra le due tensioni di vapore deve necessariamente avvenire per una temperatura più bassa.
35) Descrivere il fenomeno della abbassamento crioscopico :
Si abbassa il punto di gelo della soluzione rispetto al punto di gelo del solvente puro. Dcr = Kcr * molalità
36) Spiegare perchè si getta il sale sulle strade di montagna nei periodi invernali:
I sali sono caratterizzati dal fatto che sono completamente dissociati, quindi nel caso minimo (ad esempio NaCl) il fattore di Van´t Hoff è pari a 2. ciò significa che DCR = KCR * molalità * 2 , quindi non si fa altro che abbassare la soglia a cui la acqua gela, evitando in tal modo la formazione di ghiaccio.
37) Cosa è il punto di ebollizione di un liquido:
È la temperatura alla quale la tensione di vapore del liquido eguaglia la pressione esterna.
Abbiamo visto che la tensione di vapore della soluzione è inferiore alla tensione di vapore del solvente allo stato puro e pertanto se questa tensione di vapore decresce occorrerà una temperatura più alta per eguagliare la pressione esterna..
38) Descrivere il fenomeno della innalzamento ebulloscopico :
Si innalza il punto di ebollizione della soluzione rispetto al punto di gelo del solvente puro. Deb = Keb * molalità
39) Spiegare perchè, quando si getta del sale nella acqua che bolle, questa sembra calmarsi :
I sali sono caratterizzati dal fatto che sono completamente dissociati, quindi nel caso minimo (ad esempio NaCl) il fattore di Van´t Hoff è pari a 2. ciò significa che Deb = Keb * molalità * 2 , quindi non si fa altro che alzare la TEBOLLIZIONE .
40) Cosa è una membrana semipermeabile:
È una parete che lascia passare le molecole di solvente ma non quelle di soluto consentendo di misurarne la pressione osmotica da queste esercitata.
41) Che cosa è la pressione osmotica:
È la tendenza delle molecole di soluto ad espandersi in tutto il volume di solvente a disposizione.
La sua espressione è simile a quella dei gas ideali p V = n R T dove n è il n° di moli di soluto mentre p, V e T si riferiscono alla soluzione. È possibile anche una variante di questa formula cioè Posmotica p = c R T dove c =n / V .
42) A cosa è dovuto il fatto che la pressione osmotica si esprime con una legge simile a quella dei gas ideali:
Essa misura in maniera del tutto analoga la tendenza delle molecole di solvente ad espandersi in tutto il volume di soluzione a loro disposizione.
43) Che rapporto c´è tra la pressione osmotica p ed il dislivello in un ramo di un tubo ad U :
p = h (cm) * densità (g/cm3) * 981 (dine) = ........ dine/cm2 = [ (.......... dine/cm2 ) / 1,013*106 ] atmosfere
44) Per una soluzione di HNO3 in acqua, occorre considerare il binomio di Van´t Hoff :
Occorre considerarlo nel caso ci siano dati relativi a qualsiasi proprietà colligativa, in quanto HNO3 è un acido forte e pertanto completamente dissociato, quindi il fattore i per il quale vanno moltiplicate tutte le proprietà colligative non vale 1 bensì 2 e non può quindi essere omesso.
45) Quanto vale la pressione osmotica per una soluzione di BaCl2 e KCl :
p = CTOT * R * T
dove CTOT = C(BaCl2) * i (BaCl2) + C(KCl) * i (KCl) = C(BaCl2) * 3 + C(KCl) * 2
46) Quando 2 soluzioni sono isotoniche:
Quando hanno la stessa pressione osmotica.