Dissociazione elettrolitica ed Elettrolisi
1) Per quali soluzioni le proprietà colligative assumono valori diversi da quelli teorici:
Per le soluzioni di soluti che si dissociano, quali i sali, le basi e gli acidi, che vengono detti elettroliti. Il fenomeno è appunto dovuto al fatto che il dissociarsi di un elemento aumenta il n° di particelle presenti in soluzione e pertanto debbono aumentare anche i valori delle proprietà colligative che sono direttamente collegate al n° di particelle.
2) Quale è la causa della dissociazione degli ioni della elettrolita in acqua:
Ci sono 2 cause :
a) L´acqua ha una costante dielettrica 80 volte maggiore rispetto al vuoto, e siccome questa è inversamente proporzionale alla energia potenziale di 2 cariche elettriche poste a distanza r , segue che l´energia necessaria per rompere il legame quando questo è in acqua è notevolmente inferiore rispetto alla forza che sarebbe necessaria se il legame fosse nel vuoto.
b) la solvatazione comporta che intorno ad ogni ione si formi una nuvola di molecole d´acqua le quali espongono la parte negativa del loro dipolo, cioè l´ossigeno, la loro attrazione è tale da rompere il legame che in acqua è divenuto debole e da creare degli ioni solvatati.
3) Cosa si intende con la formula Na+ * 5H2O :
Si intende che si ha uno ione di sodio solvatato, cioè idratato con 5 molecole d´acqua.
4) Come si ripristina la validità delle formule per le proprietà colligative:
Occorre legarle al grado di ionizzazione moltiplicandole per il binomio di Van´t Hoff ![]() dove v è il n° di moli di ioni che si formano " mole di soluto.
dove v è il n° di moli di ioni che si formano " mole di soluto.
5) Che cosa è la diluizione di una soluzione:
Quando si è in tanti e si stà stretti si dice che si è concentrati mentre quando si è in pochi e si stà larghi, si dice che si è diluiti.
6) Enunciare la legge di diluizione di Ostwald in termini di concentrazione e di grado di dissociazione:
![]() = costante di ionizzazione ad una data temperatura.
= costante di ionizzazione ad una data temperatura.
7) Come varia la costante di ionizzazione con la concentrazione:
La costante di ionizzazione è espressa in termini di concentrazione, mentre la vera costante termodinamica è espressa in termini di attività. Le 2 costanti coincidono soltanto per soluzioni molto diluite questo perchè quando la concentrazione aumenta, gli ioni si trovano come in via del corso la Domenica, fanno cioè difficoltà a muoversi. Questa proprietà è estrinsecata attraverso il coefficiente di attività f il quale appunto decresce con la concentrazione per via delle ridotte attrazioni elettrostatiche.
8) Cosa è la forza ionica:
È una misura della densità di carica della soluzione e quindi delle azioni elettrostatiche cui un dato ione è sottoposto da parte di tutti gli altri.
![]()
9) Che relazione c´è tra il coefficiente di attività f e la forza ionica m :
Per soluzioni caratterizzate dalla stessa forza ionica, il coefficiente di attività è sempre lo stesso indipendentemente dalla natura degli altri elettroliti presenti.
10) Che rapporto c´è tra la diluizione di una soluzione ed il grado di ionizzazione:
Dalla legge di Ostwald si osserva che se c decresce, ad esempio a seguito di un aumento di volume, dovendo rimanere K costante per una data temperatura, allora ![]() deve crescere, e questo si ottiene aumentando il grado di dissociazione.
deve crescere, e questo si ottiene aumentando il grado di dissociazione.
11) Cosa è la solubilità di una sostanza in un dato solvente:
Il fenomeno che la solubilità intende descrivere è il fatto che si getta l´idrolitina nella acqua ed essa non si scioglie completamente bensì rimane un corpo di fondo e la soluzione acqua-idrolitina si dice satura.
È definita come il numero di moli di sostanza che si sciolgono in un litro di soluzione, cioè la concentrazione molare della soluzione satura.
12) Cosa è il prodotto di solubilità di un elettrolita poco solubile:
Si ottiene dalla Kc applicata all´equilibrio di una soluzione di un elettrolita poco solubile in equilibrio con la sua soluzione satura. È importante perchè quando il prodotto delle concentrazioni degli anioni e dei cationi supera il valore del prodotto di solubilità si forma del precipitato sin quando le concentrazioni non verificano il prodotto di solubilità.
Tanto più piccolo è il valore del prodotto di solubilità tanto meno solubile è il sale in questione.
13) Come si può calcolare la solubilità di un sale:
Si prende la reazione di dissociazione e si pone la concentrazione del sale pari ad s, dopodichè si fà il prodotto di solubilità moltiplicando per s il coefficiente stechiometrico del rispettivo ione, il tal modo si ottiene asX e si può ricavare s tramite la radice x-esima del prodotto di solubilità diviso a.
14) Cosa è l´effetto dello ione comune:
È la ulteriore diminuizione della solubilità di un elettrolita poco solubile (che si scioglie poco) a seguito della inserimento nella soluzione di uno degli ioni provenienti dalla dissociazione della elettrolita stesso. Ciò si spiega col fatto che la reazione avviene in modo da consumare tutto la altro ione e quindi si produrrà maggior precipitato.
15) Come si può aumentare la solubilità di un dato sale, quale ad esempio il calcare delle lavatrici:
Occorre agevolare la reazione sottraendo i prodotti, il che non avviene con piccole pinzette bensì con acidi e basi opportuni che si combinano con i singoli ioni e creano in tal modo sostanze che per dar senso al tutto non debbono essere allo stato solido.
16) Che rapporto c´è tra la solubilità e la temperatura:
Lo stesso rapporto che c´è tra qualsiasi equilibrio e la temperatura, la quale per la appunto sposta l´equilibrio verso i reagenti, pertanto un sale non disciolto, si scioglie parzialmente aumentando la temperatura.
17) Cosa è la corrente elettrica:
È un flusso ordinato di cariche che può aver luogo in conduttori di prima e di seconda specie. Nei primi è dovuta al moto degli elettroni, nei secondi è invece dovuta al moto degli ioni.
18) Quale è il meccanismo per il quale si ha passaggio di corrente nei conduttori di 1ª specie:
I conduttori di 1ª specie sono i metalli ed i liquidi ed in essi la corrente è trasportata esclusivamente da elettroni. Tale comportamento è ben definito dal legame metallico che prevede un reticolo di ioni positivi ed intorno ad essi una nuvola di elettroni.
19) Quale è il meccanismo per il quale si ha passaggio di corrente nei conduttori di 2ª specie:
I conduttori di 2ª specie sono i sali solidi e liquidi e le soluzioni di elettroliti, costituite cioè da sali, basi o acidi disciolti in acqua. Il moto ordinato si genera a seguito della applicazione di una differenza di potenziale elettrico, in 3 fasi :
a) il generatore sottrae elettroni ad un elettrodo(anodo) e li fornisce alla altro(catodo) pertanto la anodo è carico positivamente mentre il catodo è carico negativamente.
b) Il catodo attrae gli ioni positivi che si sono formati dalla dissociazione del soluto elettrolita in acqua, tali ioni positivi vengono chiamati cationi, intorno al catodo ce ne sarà un gran numero.
L´anodo attrae gli ioni negativi che si sono formati dalla dissociazione del soluto elettrolita in acqua, tali ioni negativi vengono chiamati anioni, intorno alla anodo ce ne sarà un gran numero.
c) Abbiamo a contatto 2 distribuzioni di cariche che si attraggono, ma non ci può essere passaggio in quanto le modalità di trasferimento della corrente elettrica sono diverse nei 2 conduttori, questa invece fluisce in quanto si instaurano delle reazioni di riduzione(la soluzione acquista elettroni) al catodo e di ossidazione(la soluzione cede elettroni) alla anodo.
20) Cosa è un catodo:
È l´elettrodo o lamina metallica a potenziale negativo verso cui migrano i cationi presenti in soluzione.
21) Cosa è la resistenza di un conduttore:
È il fattore che lega l´effetto ossia la corrente elettrica alla causa ossia la differenza di potenziale, essa è caratteristica di ogni diverso materiale, ed è legata alla sua sezione, alla sua lunghezza ed alla sua resistività secondo la 2ª legge di Ohm:
![]()
22) Cosa è la costante per una cella elettrolitica:
È il rapporto ![]() che è appunto una costante per una cella elettrolitica e si misura in cm-1.
che è appunto una costante per una cella elettrolitica e si misura in cm-1.
23) Cosa è la conduttanza K di un conduttore:
È l´inverso della resistenza ed indica appunto quanto un conduttore si presta ad essere attraversato da corrente elettrica
![]() dove c è l´inverso della resistività ed è denominata conduttività o conducibilità specifica.
dove c è l´inverso della resistività ed è denominata conduttività o conducibilità specifica.
24) Quali sono i fattori che influenzano la conduttanza K di una soluzione:
La conduttanza è sicuramente legata al n° di cationi ed anioni presenti in acqua, e questo abbiamo visto cresce con la diluizione ossia con il volume. È poi legata alla mobilità di questi ioni.
25) Quanto vale la conduttanza K di 2 processi di conduzione che avvengono parallelamente:
È la somma delle conduttanze dei singoli processi.
26) La conduttività specifica c di una soluzione acquosa è influenzata dalla conduttività specifica c della acqua:
No in quanto la c della acqua è molto bassa, tuttavia per misure di estrema precisione essa và sottratta alla c misurata.
27) Cosa è il peso equivalente per un elettrolita:
È il rapporto tra il suo peso molecolare ed il prodotto del n° di moli di cationi che si formano per il n° di cariche positive associate ad ogni mole, ad esempio per il Cu(SO4) prendendo come riferimento il Cu2+ abbiamo che PE = PM / ( 1*2). Tale valore è identico se calcolato rispetto alla anione (SO4)2- .
28) Cosa è la costante di Faraday:
È la carica totale positiva o negativa che si può ottenere dalla completa dissociazione di 1 g-equivalente di un qualsiasi elettrolita, essa è pari al prodotto del n° di Avogadro per la carica del singolo elettrone. À e = F .
1 Faraday = 96487 Coulomb = 26,8 Ah
29) Cosa è la conducibilità equivalente L:
Essa si propone di legare la conduttanza di una soluzione alla sua concentrazione ![]() dove N è la normalità che è pari al prodotto della molarità per il n° di cariche dello ione. Es: H2+ occorre moltiplicare per 2 la molarità.
dove N è la normalità che è pari al prodotto della molarità per il n° di cariche dello ione. Es: H2+ occorre moltiplicare per 2 la molarità.
Viene definita come la conduttanza di quel volume di soluzione che contiene disciolto 1 equivalente di elettrolita, misurata tra 2 elettrodi paralleli alla distanza di 1 cm.
30) Cosa è la conducibilità equivalente limite L¥ :
Si osserva che per soluzioni deboli, anche aumentando la diluizione, non si ha più aumento della conducibilità equivalente, pertanto il valore massimo da essa raggiunto viene definito limite, esso è legato al fatto che aumentando la diluizione è aumentata anche la dissociazione sino al valore massimo a = 1 cui corrisponde appunto L¥ quindi essa è utile perchè sgancia la conduttività dalla concentrazione e pertanto essa rimane soltanto legata alla mobilità dello ione.
31) Che rapporto c´è tra la conducibilità equivalente e la conducibilità equivalente limite:
![]()
32) Enunciare la legge di diluizione di Ostwald in termini di L e di L¥ :
![]()
33) Enunciare la legge di Kohlraush :
Ogni ione contribuisce in misura caratteristica e costante alla conducibilità equivalente limite di un elettrolita, ed il suo contributo è indipendente dalla natura della altro ione proveniente dalla dissociazione della elettrolita.
![]()
34) Perchè L¥ degli ioni (H3O+ ) ed (OH- ) in acqua sono molto più elevate rispetto ad altri ioni:
La elevata conducibilità non è dovuta alla particolare mobilità di questi ioni bensì al fatto che in acqua essi formano e creano in continuità un gran numero di legami O-H sotto l´influenza di un campo elettrico, pertanto i protoni si muovono da una molecola alla altra raggiungendo l´elettrodo opportuno.
35) Cosa è l´elettrolisi:
È il fenomeno per il quale si ha una trasformazione chimica di una soluzione mediante ossidoriduzioni quando questa è attraversata da corrente elettrica. Il fenomeno è dovuto allo scaricarsi degli ioni presenti in soluzione sul rispettivo elettrodo. La quantità di sostanza è legata alla quantità di elettricità che attraversa la soluzione ed al peso equivalente della sostanza considerata.
36) Origine del nome elettrolisi:
Lisi = rottura , quindi si intende la rottura dei legami per via elettrica.
37) Relazione tra la pila e l´elettrolisi:
Sono 2 processi complementari, il 1° è spontaneo ed ha lo scopo di produrre energia elettrica tramite delle reazioni di ossidoriduzione, mentre il 2° non è spontaneo e necessità della energia fornita da una pila per realizzare delle reazioni di ossidoriduzione al fine di separare sostanze allo stato puro presenti in soluzione come ioni.
38) Nel processo della elettrolisi quale elettrodo è il catodo, quale la anodo e che potenziale hanno:
Il catodo è per definizione l´elettrodo dove avviene la riduzione e quindi si forma la sostanza allo stato puro, per avvenire la riduzione, richiede elettroni da fornire alla soluzione i quali questa volta sono forniti dalla pila e pertanto il catodo è l´elettrodo più negativo. Il polo positivo della batteria connesso all´elettrodo anodo, ne ciuccia via gli elettroni consentendo quindi la formazione di ioni positivi che si liberano in acqua, e si vanno a ricombinare sul catodo con gli elettroni provenienti dalla pila.
39) Avendo in soluzione n coppie ossidoriduttive, quale si scaricherà alla anodo:
Ricordando che alla anodo avviene la ossidazione, si ossiderà la coppia ossidoriduttiva avente potenziale elettrodico più basso mentre al catodo avvenendo la riduzione, si scaricherà la coppia avente potenziale elettrodico più positivo.
40) È possibile ottenere la decomposizione dei metalli alcalini ed alcalini terrosi in soluzioni acquose:
No, in quanto hanno potenziale elettrodico inferiore rispetto alla coppia H3O+ / H2 e dunque è questa a ridursi.
41) Enunciare le 2 leggi di Faraday sull´elettrolisi :
a) Le quantità di sostanze che si formano agli elettrodi sono proporzionali alla quantità di elettricità che ha attraversato la soluzione.
b) I pesi di 2 diverse sostanze prodotte dalla stessa quantità di elettricità sono proporzionali ai pesi equivalenti delle sostanze stesse.
42) Enunciare la formula di Faraday per ricavare la quantità di sostanza prodotta tramite elettrolisi:
![]() dove F è la costante di Faraday, il peso equivalente come per le ossidoriduzioni si calcola dividendo il peso molecolare della sostanza per il n° di elettroni scambiati. In termini di moli si può invece impostare la proporzione :
dove F è la costante di Faraday, il peso equivalente come per le ossidoriduzioni si calcola dividendo il peso molecolare della sostanza per il n° di elettroni scambiati. In termini di moli si può invece impostare la proporzione :
1 Faraday : 1 mole = Q : x_moli
infatti 1 faraday è la quantità di carica associata ad una mole di elettroni.
43) Estrinsecare le conseguenze del passaggio di corrente in una soluzione :
Al catodo avviene la riduzione con formazione di sostanze allo stato non ionico, il generatore fornisce elettroni affinchà ciò accada, alla anodo avviene la ossidazione nel corso della quale gli elettroni vengono ceduti al generatore chiudendo in tal modo il circuito.
44) Cosa si intende per rendimento faradico:
La quantità di sostanza prodotta in pratica è inferiore rispetto a quella calcolata per via della insturarsi di numerosi processi di ossidoriduzione, tra cui lo scaricarsi degli ioni H3O+ pertanto viene definito un rendimento faradico della elettrolisi
![]() equivalente al rendimento di corrente
equivalente al rendimento di corrente
![]()
45) Cosa è il potenziale di decomposizione di una soluzione:
È il potenziale ED oltre il quale la soluzione ha una diretta proporzionalità tra la differenza di potenziale applicata e la intensità di corrente che attraversa la soluzione. Prima che venga raggiunto questo potenziale al crescere della tensione applicata la corrente aumenta in maniera irrilevante.
46) Enunciare la legge di Ohm per i conduttori di 2ª specie :
![]()
47) A quali cause è legato il fenomeno descritto dal potenziale di decomposizione:
Esso è la somma di 2 fattori ;
a) Appena iniziano la riduzione e l´ossidazione, si genera una pila interna alla soluzione che si oppone alla fem esterna come in un circuito potenziometrico, aumentando la tensione esterna la fem della pila interna cresce in maniera speculare sino a giungere ad un valore ER detto potenziale reversibile di ionizzazione, oltre il quale ha il sopravvento la pila esterna.
b) Il processo in realtà non è reversibile ed i processi che compongono l´elettrolisi debbono avvenire a velocità adeguata, se uno di essi è più lento, si rende necessaria una sovratensione che compensi questo stadio lento.
48) Come si calcola il potenziale di decomposizione per una data cella elettrolitica:
ED = EANODO - ECATODO
dove EANODO è il potenziale associato alla reazione di ossidazione che avviene alla anodo la quale è quella a potenziale di Nernst più basso tra tutte. ECATODO invece è il potenziale associato alla reazione di riduzione che avviene al catodo la quale è quella a potenziale di Nernst più alto tra tutte.
49) Sapendo che la sovratensione di scarica della idrogeno sul nickel vale 0,21v determinare la reazione ed il potenziale ad essa associato:
2 H3O+ + 2e ® H2 (G) + 2 H2O

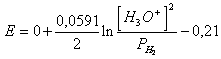
50) Sapendo che la sovratensione della ossigeno sul platino vale 0,48v determinare la reazione ed il potenziale ad essa associato:
6 H2O ® O2 (G) + 4 H3O+ + 4e
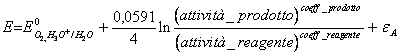
![]()
51) Quali processi si generano nel corso della elettrolisi:
a) Nuovi ioni in soluzione debbono diffondere nei pressi della anodo per sostituire quelli che si scaricano.
b) Gli ioni in realtà sono solvatati ed è quindi necessaria della energia supplementare per disidratarli.
c) Gli ioni che si sono scaricati debbono unirsi per creare un cristallo stabile, il che richiede energia.
d) Se la sostanza generata per riduzione è allo stato di gas, questa si deve separare dalla anodo.
52) Cosa è un voltametro ad argento:
È uno strumento in grado di misurare la quantità di elettricità che attraversa un dato circuito semplicemente utilizzando la legge di Faraday ossia misurando le quantità di sostanza che si depositano sul catodo. È costituito da due elettrodi di argento immersi in una soluzione di Ag(NO)3 .