Ley de la accin de la masa
1) cuando una reaccin qumica es completa:
Cuando prcticamente todo el reactivo es scomparso para dar el lugar al producto de la misma reaccin.
2) que Relazioneship est entre la energa libre DG y el equilibrio de una reaccin qumica:
Independientemente de la situacin los comienza que el sistema estira siempre espontneamente para llevarse a la misma composicin del equilibrio, que corresponde el valor mnimo de la energa libre.
3) cunto vale DG para una reaccin en equilibrio:
Vale 0 como para todos los procesos en equilibrio.
4) declara la ley de la accin de la masa:
Cuando una reaccin a la temperatura constante coge para arriba el equilibrio, viene defini una termodinmica constante del equilibrio que en prctico representa la produccin de la reaccin, que es el Relazioneship entre los productos y los reactivo una vez que se ha arrestado la reaccin.
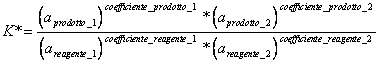
donde a ella est la actividad del correspondiente de la sustancia a la concentracin ideal.
* para los gases ideales = presin
* para los gases no ideales a = f * p donde est el coeficiente f l de la actividad
* para los lquidos slidos y puros la actividad es unitaria.
* para una solucin ideal = concentracin.
* para una solucin no ideal a = f * donde est el coeficiente f l de la actividad.
5) declara la constante del equilibrio basada en la concentracin:
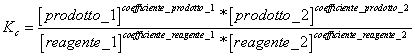
viene utilizado en las reacciones que tienen lugar en fase gaseosa y para las reacciones en la solucin.
6) en el cual ocasin K * y Kc coinciden:
En todos esos casos en los cuales la actividad coincide con la concentracin, como como ejemplo para los gases que siguen el comportamiento ideal (a la presin baja) y para las soluciones diluidas mucho. Es de notar que solamente K* est riguroso la constante a cada temperatura insensible y a los reactivo y a los productos de las diosas de las variaciones de presin.
7) que la constante del equilibrio que viene utiliz en las reacciones que interesan aeriform:
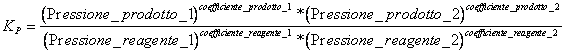
Las sustancias se deben tomar naturalmente en la consideracin solamente que en la reaccin se introducen al estado gaseoso.
8) que aleacin K cy K pde la relacin :
Kp = Kc (RT)Dn donde estla diferencia D n entre n de los wharves de los productos y la n de wharves de reactivo
Uno obtiene la observacin de que c = massa/volume = n/V y para un gas = P/ RT parciales, substituyendo en la Kc obtiene el esito.
En este tamao del caso de R * K vale 0.0821 (l * atmsfera/)
9) declara la constante del equilibrio en trminos de las muelas de las fracciones:
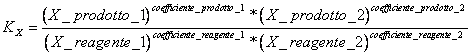
viene utilizado en las reacciones que tienen lugar en fase gaseosa y para las reacciones en la solucin.
10) que aleacin K Xy K Pde la relacin :
KP = KX * (TOTALde P )Dn donde estla diferencia D n entre n de los wharves de los productos y la n de wharves de reactivo
11) en esa ocasin KP, KC, KX coincide:
Cuando la reaccin sucede sin el cambio de la n de los wharves de las sustancias gaseosas.
12) que la relacin est entre las constantes del equilibrio y la produccin de una reaccin:
a) si k > > 1 entonces la reaccin tiene el equilibrio movido a la derecha que est hacia los productos.
b) si k < < 1 entonces la reaccin tiene el equilibrio movido a la izquierda que est hacia los reactivo.
13) cunto vale la constante del equilibrio para la reaccin inversa aqulla considerada:
Es el mutuo de la constante del calcular del equiibrio para la reaccin directa.
14) cunto vale la constante de equilibrio si la reaccin para n se multiplica:
La constante nueva de equilibrio es igual a la vieja constante elevada al n-esima de la energa.
15) cunto vale la constante del equilibrio para la suma de la reaccin de 2 reacciones:
Es el producto de las constantes de las 2 reacciones agregadas.
16) declara la constante del equilibrio en la variacin del della de la funcin de la energa libre por medio del isoterma de la relacin de la furgoneta ' t Hoff:
DG = - ln K de R T
donde K puede ser una cualquiera de las constantes del equilibrio en cunto es solamente valor a ejercer presin sobre y temperatura la relacin constante. R resulta el igual a 1.98 cal/(K*mole) y DG resultar expresado en cal/size por lo tanto si los wharves interesados son ms de uno son necesarios multiplicar DG para su nmero solamente de tal manera pueden saber la variacin de la energa libre resuelta de la reaccin.
17) cunto vale DG para la reaccin: 2 Cl 2 De NOCl "2NO :
DG = 2Gf () Gf (cl2) - 2Gf (NOCl) y el no ser Gf (elemento en su estndar del estado) = 0 entonces
DG = 2Gf (NINGUNA) - 2Gf (NOCl)
18) describe el isocora de la relacin de la furgoneta ' t Hoff en forma los distingue que aleacin la constante del equilibrio a la temperatura:
![]()
se observa:
a) si DH0 < 0 la reaccin es exotrmica y la constante de equilibrio disminuye al crecimiento de la temperatura.
b) si esDH 0 = 0 la reaccin el termoneutrale y la constante de equilibrio es independientes de la temperatura.
c) si DH0 > 0 la reaccin es endotrmica y la constante de equilibrio viene el crecimiento de la temperatura.
19) describe el isocora de la relacin de la furgoneta ' t Hoff en forma integral que alea la constante del equilibrio a la temperatura:
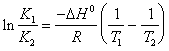
En l R resulta el igual a 1.98 cal/(K*mole) y DH resultar expresado en cal/size.
Para notar que esta expresin es solos intervalos pequeos de consideracin vlidos de la temperatura, en que encajonan DH0 puede ser considerado constante
20) pues el isocora es integral transformado de la furgoneta ' t Hoff para los equilibriums en medio se hace de un sistema a un solo miembro:
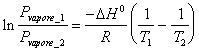
Esto porqu en los sistemas a un solo miembro pde K la actividad es igual a la sola tensin del vapor en cunto para el lquido es unitario. Anlogo para Kc .
21) cunto vale DH para la reaccin: 2 Cl 2 De NOCl "2NO :
DH = " 2Hf () Hf (cl2) - 2Hf (NOCl) y el no ser Hf (elemento en su estndar del estado) = 0 entonces
DH = " 2Hf (NINGUNA) - 2Hf (NOCl)
22) declara el principio del Chatelier o del equilibrio mvil:
Cuando una alteracin las variables se provoca del exterior (P, T, concentracin) de un sistema en equilibrio, el equilibrio se mueve en un sentido que se oponga a la variacin trada, estirando para disminuir los efectos.
23) la cosa sucede si se procura para aumentar la concentracin de un elemento en la reaccin:
La constante de equilibrio debe seguir siendo constante y por lo tanto si aumenta la concentracin de una sustancia, las otras sustancias de la reaccin cambiar su concentracin para para hacer que la constantedel restos de K c, que desea decir que el sistema reaccione para para consumir el exceso compuesto.
24) que el efecto tiene una variacin de la presin externa en un sistema en equilibrio:
Depende del tipo de reaccin, como ejemplo en la reaccin N2 3H2 " 2NH3 si la reaccin procede hacia dx, la n de wharves disminuye, por lo tanto si como viene un ejemplo l aument la presin externa en este sistema en el equilibrio, l intenta contestar para para cancelar este aumento de la presin, que es mudanza obtenida el equilibrio hacia la n ms pequea de los wharves, que es l seguir siendo pieza pequea el reactivo en cunto transforma casi totalmente a usted en los productos de la reaccin.
25) cuando una transformacin qumica dice homogenous y cuando es heterogneo:
Cuando es reatti a usted que produjo que estn presentes en una nica fase, heterognea si las sustancias en equilibrio qumico son presentes en 2 o ms se hace.
26) como vienen influenciaron los dissosciations gaseosos de la presin y de la temperatura:
Deben ser expresadas en los trminos del grado de dissosciation a, que tendr que cambiar para para balancear los que sean los cambios de la presin o de la temperatura, bastante del resto para observar que el dissosciation es una reaccin que sucede con el aumento de la n de wharves y por lo tanto es preferida a partir de un diminuizione de la presin externa.
Se observa por otra parte eso que es el dissosciation caracterizado de la abertura de lazos, no puede el ser endotrmico, que es con la compra del calor de la atmsfera y por lo tanto es preferido de un aumento de la temperatura.
27) declara en trminos a los wharves para la reaccin: 2 Cl 2 De NOCl "2NO :
2 NOCl " 2 NINGN Cl2
n0(1 - a) (n0a ) (n0a)/2
eventual otros wharves que estaban presentes para los productos de la reaccin, van agregado ya a los actuales trminos. Si otros reactivo estuvieran presentes, la reaccin no se podra escribir en trminos de a en cunto no hara caso de la contribucin en los productos. El dissosciation tiene solamente por lo tanto sentido para estas reacciones donde un scinde compuesto en 2 o ms miembros.
28) declara en los trminos disociados reaccin de wharves: 2 Cl 2 De NOCl "2NO :
2 NOCl " 2 NINGN Cl2
n0(NOCl) - 2x n0(NO) 2x n0(cl2) x
29) como estimar si uno dado la reaccin est en equilibrio y, si l no es, en el cual el sentido pasa espontneamente:
Se estima la D el lnQ de G = de D G RT. Los casos siguientes pueden ser introducidos:
DG = 0 en tales caso la reaccin est en equilibrio.
DG < 0 que la reaccin pasa espontneamente de sx hacia dx.
DG > 0 que la reaccin pasa espontneamente de dx hacia sx.
En este ltimo caso un clculo eventual de los wharves ve de antemano que los wharves que disminuyen con respecto a la situacin los comienzan son los de los miembros que se encuentran al dx en la reaccin, mientras que los miembros al sx aumentan la n de wharves.
30) en los equilibriums en los cuales los gases aparecen el slido y, que es la importancia de los wharves de el slido:
Los wharves de el slido se consumen que estn en Relazioneship stoichiometric exacto con los valores de los wharves se crean que que debe sino ser obtenido con las constantes de equilibrio. Como ejemplo en el clculo de los wharves suma para el kc, ellos van consideraba solamente los wharves de gases.
31) como vienen influenciaron los equilibriums de los sistemas y de los lquidos slidos de las modificaciones de la presin o de la temperatura:
La presin tiene mnimos de los efectos en cunto en estas reacciones es escaso las variaciones del volumen.
32) como uno puede estar la reaccin del velocizzare:
Si es necesidad reversible s mismo qutese los productos como formas s mismo de la reaccin, de tal manera que el proceso sucede de manera casi termina.
33) mientras que vienen l influencian los equilibriums heterogneos a usted de variaciones de la temperatura o de presin:
Hay las reacciones para las cuales siendo actuales lquidos, slido y gas, es inmediato entender en qu sentido se realiza la reaccin con aumento del volumen, la reaccin resultar estimulado en tal sentido si la presin externa disminuye.
Es intuitivo como ejemplo para pensar que si se aumenta la presin, la arreglar-reaccio'n intentar disminuir su presin y por lo tanto el equilibrio ser para sfavorire movido la creacin del gas con respecto a lquidos slidos o.
34) que el particularitity tiene equilibrio el (G)del NH4HS (s) "NH 3 (s)H2S
El reactivo se encuentra al de estado slido por lo tanto no aparece cualesquiera en KC a travs de la cual enK P ni uno ni otro en un cierto clculo eventual de los wharves PV = n RT, de que l tenga solamente sentido para los miembros al estado gaseoso.
35) para el equilibrio SnO2 2 H2(G) " el sn(s) 2 2Ho(g) como 5 wharves de sn pueden ser obtenidos:
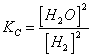 Famoso debe ser hecho s que [ H2 ] es tal que los wharves de H2 son 10 que sea la cantidad doble de
los wharves de la charca.
Famoso debe ser hecho s que [ H2 ] es tal que los wharves de H2 son 10 que sea la cantidad doble de
los wharves de la charca.
36) para el equilibrio C(s) Ho(G)de 2 (g) el "CO H2 (g) cunto agua me es necesaria para los wharves del gasare 1.1 de C(s) :
1.1 wharves de CO y 1.1 wharves de o 2 deben ser creados , de modo que se suceda dve al desumere los wharves al equilibrio de la KP y a stos para agregar 1.1.
37) porqu si el lasci abri el agua mineral este sgasa:
Si la botella es esclusa hay de CO2 entre el agua y el tapn que tiene una presin determinada, si abrimos la botella, salidas de esteCO 2 y la presin a la cual ella es subordinada la solucin es mucho lo ms bajo posible la, por lo tanto CO 2bajo forma del bollicine que entren para arriba en superficie, en la tentativa intil de la parte de la solucin ser producido para contestar a esta variacin de los extremos del sistema por lo tanto a que nel.giro.di 10 minuteren el sgasa del agua totalmente.