Gesetz der Tätigkeit der Masse
1) wenn eine chemische Reaktion komplett ist:
Wenn das praktisch ganzes Reagens scomparso, zwecks Platz zum Produkt der gleichen Reaktion zu geben ist.
2) daß Verhältnis zwischen der freien Energie D Gund dem Gleichgewicht von einer chemischen Reaktion ist:
Unabhängig von der Situation fängt es sie an, die das System immer spontan ausdehnt, um sich zum gleichen Aufbau des Gleichgewichts zu tragen, den der minimale Wert der freien Energie entspricht.
3) wieviel D Gfür eine Reaktion im Gleichgewicht wertIST:
EsIST 0 wie für alle Prozesse im Gleichgewicht wert.
4) Enounce das Gesetz der Tätigkeit der Masse:
Wenn eine Reaktion auf konstante Temperatur sich oben das Gleichgewicht verfängt, kommt sie definierte eine konstante Thermodynamik des Gleichgewichts, das in praktischem das Ergebnis der Reaktion darstellt, die das Verhältnis zwischen Produkten und Reagenzien einmal ist, daß die Reaktion festgehalten worden ist.

wo zu ihr die Tätigkeit des Substanzkorrespondenten zur idealen Konzentration ist.
* für ideale Gase = Druck
* für nicht ideale Gase zu = f * p, wo f es der Tätigkeit Koeffizient ist
* für die festen und reinen Flüssigkeiten ist die Tätigkeit einheitlich.
* für eine ideale Lösung = Konzentration.
* für eine nicht ideale Lösung zu = f * wo f es der Tätigkeit Koeffizient ist.
5) Enounce die Konstante des Gleichgewichts basiert auf der Konzentration:

sie kommt verwendet in den Reaktionen, die Platz in der gasförmigen Phase und für die Reaktionen in gelöster Form haben.
6) in dem Gelegenheit K * und Kc stimmen sie überein:
In in denen allen jenen Fällen die Tätigkeit stimmt es mit der Konzentration, wie als Beispiel für die Gase überein, die dem idealen Verhalten (zum Niederdruck) und für die verdünnten Lösungen viel folgen. Es ist vom Beachten daß nur K* rigoros ist Konstante zu jeder unempfindlichen Temperatur und zu den Druckschwankunggöttinreagenzien und -produkten.
7) das Konstante des Gleichgewichts, das sie kommt, in den Reaktionen verwendete, die aeriform interessieren:

Natürlich müssen die Substanzen in Betracht nur gezogen werden, die in der Reaktion zum gasförmigen Zustand eingeführt werden.
8) das Relation Legierung Kc und Kp :
Kp = Kc (Funktelegraphie)Dn, wo Dn der Unterschied zwischen n° von wharves der Produkte und dem n° von wharves der Reagenzien ist
Ein erreicht das Beobachten, daß c = massa/volume = n/V und für ein Gas = teilweisesP / Funktelegraphie, ersetzend im Kc das esito erreicht.
In dieser R Fallgröße * KIST 0.0821 wert (L * ATM/)
9) Enounce die Konstante des Gleichgewichts in Bruchmolaren ausgedrückt:
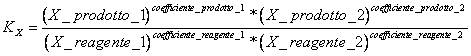
es kommt verwendet in den Reaktionen, die Platz in der gasförmigen Phase und für die Reaktionen in gelöster Form haben.
10) das Relation Legierung KX und KP :
KP = KX * (PGESAMTMENGE )Dn, wo Dn der Unterschied zwischen n° von wharves der Produkte und dem n° von wharves der Reagenzien ist
11) in dieser Gelegenheit KP, KC, KX stimmt überein:
Wenn die Reaktion ohne Änderung des n° von wharves der gasförmigen Substanzen geschieht.
12) daß Relation zwischen den Konstanten des Gleichgewichts und dem Ergebnis von einer Reaktion ist:
A), wenn k > > 1 dann die Reaktion das Gleichgewicht hat, das rechts verschoben wird, das in Richtung zu den Produkten ist.
B), wenn k < < 1 dann die Reaktion das Gleichgewicht hat, das auf dem links verschoben wird, das in Richtung zu den Reagenzien ist.
13) wieviel die Konstante des Gleichgewichts für die umgekehrte Reaktion bis diese betrachtet wertIST:
Es ist das gegenseitige der Berechnung Konstante von equiibrio für die direkte Reaktion.
14) wieviel die Gleichgewichtskonstante wertIST, wenn die Reaktion für n multipliziert wird:
Die Konstante, die vom Gleichgewicht neu ist, ist der alten Konstante gleich, die zum Energie n-esima erhöht wird.
15) wieviel die Konstante des Gleichgewichts für die Reaktion Summe von 2 Reaktionen wertIST:
Es ist das Produkt der Konstanten der 2 addierten Reaktionen.
16) Enounce die Konstante des Gleichgewichts in der Funktion della Veränderung der freien Energie mittels des Relation isoterma von Packwagen ' t Hoff:
DG° = - R T ln K
wo K eins sein kann welches der Konstanten des Gleichgewichts in, wieviel die Relation der nur zu druecken ist Wert, und konstante Temperatur. R fällt Gleichgestelltes bis 1.98 cal/(K*mole) aus und DG° dreht sich heraus folglich ausgedrückt in cal/size, wenn die interessierten wharves mehr von einem sind notwendig, um D G° fürihre Zahl nur in solch einer Weise zu multiplizieren in der LageSIND, die Veränderung der entschlossenen freien Energie von der Reaktion zu kennen sind.
17) wieviel D G°für die Reaktion wertIST: 2 NOCl " 2 NICHT Cl2 :
DG° = 2G°f () G°f (Cl2) - 2G°f (NOCl) und Sein nicht G°f (Element in seinem Zustandstandard) = 0 dann
DG° = 2G°f (KEIN) - 2G°f (NOCl)
18) beschreiben das Relation isocora von Packwagen ' t Hoff in der Form unterscheidet sie, daß Legierung die Konstante des Gleichgewichts zur Temperatur:
![]()
wird beobachtet:
A), wenn DH0 < 0 die Reaktion exothermisch ist und die Gleichgewichtskonstante verringert sich auf das Wachsen der Temperatur.
B), wenn DH0 = 0 die Reaktion ist, ist termoneutrale und die Gleichgewichtskonstante von der Temperatur unabhängig.
c), wenn DH0 > 0 die Reaktion endothermisch ist und die Gleichgewichtskonstante entwickelt sich das zu Wachsen der Temperatur.
19) beschreiben das Relation isocora von Packwagen ' t Hoff in der integralen Form, das die Konstante des Gleichgewichts zur Temperatur legieren:
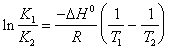
In ihm fällt R Gleichgestelltes bis 1.98 cal/(K*mole) aus und DH° dreht sich heraus ausgedrückt in cal/size.
Um daß dieser Ausdruck gültige einzelne betrachtende kleine Abstände der Temperatur, ist in zu beachten die D H0umkleiden kann es als konstant gelten
20) da das isocora umgewandeltes Integral des Packwagens ' ist, t Hoff für equilibriums zwischen wird von einem System zu einem einzelnen Mitglied gebildet:

Dieses, warum in den Systemen zu einem einzelnen K Mitgliedp die Tätigkeit der einzelnen Dampfspannung gleich ist in, wieviel für die Flüssigkeit einheitlich ist. Analog für Kc .
21) wieviel D H°für die Reaktion wertIST: 2 NOCl " 2 NICHT Cl2 :
DH° = " 2H°f () H°f (Cl2) - 2H°f (NOCl) und Sein nicht H°f (Element in seinem Zustandstandard) = 0 dann
DH° = " 2H°f (KEIN) - 2H°f (NOCl)
22) Enounce die Grundregel des Chatelier oder des beweglichen Gleichgewichts:
Wenn eine Änderung von den variablen von der Außenseite (P, T, Konzentration) eines Systems im Gleichgewicht erregt wird, wird das Gleichgewicht in eine Richtung verschoben, die der geholten Veränderung entgegengesetzt wird und dehnt aus, um die Effekte zu vermindern.
23) geschieht Sache, wenn sie versucht wird, um die Konzentration eines Elements in der Reaktion zu erhöhen:
Die Gleichgewichtskonstante muß Konstante bleiben und folglich, wenn sie die Konzentration einer Substanz erhöht, die anderen Substanzen der Reaktion ändert ihre Konzentration damit, um zu bilden daß Kc Konstante des Remains, die sagen möchte, daß das System damit reagiert, um den zusammengesetzten Überfluß zu verbrauchen.
24) dem Effekt eine Veränderung des externen Drucks auf einem System im Gleichgewicht hat:
Er hängt von der Art der Reaktion, als Beispiel in der Reaktion N2 3H2 " 2NH3 , wenn die Reaktion in Richtung zum dx fortfährt, das n° von wharves vermindert ab, folglich, wenn, als Beispiel es kommt, den externen Druck auf diesem System im Gleichgewicht, es versucht zu antworten damit, um diese Zunahme des Drucks zu annullieren erhöhte, daß es erreichtes Bewegen ist, bleibt das Gleichgewicht in Richtung zum n°, das von den wharves kleiner ist, das es ist, kleiner Reagensanteil an, wieviel fast vollständig zu Ihnen in den Produkten der Reaktion umwandelt.
25) wenn eine chemische Umwandlung homogenous sagt und wenn heterogen:
Wenn es reatti zu Ihnen ist, das produzierte, das, sie in einer einzigen Phase anwesend sind, heterogen, wenn die Substanzen im chemischen Gleichgewicht anwesend in 2 sind oder mehr wird es gebildet.
26) wie sie beeinflußten die gasförmigen dissosciations vom Druck und von der Temperatur kommen:
Sie müssen in dem Grad von dissosciation ausgedrückt zu ausgedrückt werden, den es ändern muß damit, um die auszugleichen, die die Änderungen des Drucks oder der Temperatur sind, genug des Restes, um zu beobachten, daß das dissosciation eine Reaktion ist, die mit Zunahme des n° von wharves geschieht und folglich ist es von einem diminuizione des externen Drucks Lieblings.
Es wird außerdem dem beobachtet, das das dissosciation ist, das vom Bruch der Riegel gekennzeichnet wird, kann es nicht das, endothermisch sein, das mit Erwerb der Hitze von der Atmosphäre ist und folglich von einer Temperaturzunahme Lieblings ist.
27) Enounce in zu den wharves für die Reaktion ausgedrückt: 2 NOCl " 2 NICHT Cl2 :
2 NOCl " 2 KEIN Cl2
n0(1 - zu) (n0zu ) (n0zu)/2
etwaig gehen andere wharves, die für die Reaktion Produkte anwesend waren, hinzugefügt den bereits anwesenden Bezeichnungen. Wenn andere Reagenzien anwesend waren, könnte die Reaktion nicht geschrieben werden in zu in, wieviel den Beitrag auf den Produkten ignorieren würde. Das dissosciation nur folglich Richtung für diese Reaktionen in denen ein zusammengesetztes scinde in 2 oder mehr Mitgliedern hat.
28) trennte Enounce in der Reaktion Bezeichnungen von wharves: 2 NOCl " 2 NICHT Cl2 :
2 NOCl " 2 KEIN Cl2
n0(NOCl) - 2x n0(NICHT) 2x n0(Cl2) x
29) wie das Schätzen, wenn ein, das Reaktion gegeben wird, im Gleichgewicht ist und, wenn es es nicht ist, in dem Richtung spontan überschreitet:
Das D G =D G° Funktelegraphie ln Q wird geschätzt. Die folgenden Fälle können eingeführt werden:
DG = 0 in so Fall die Reaktion ist im Gleichgewicht.
DG < 0 , welches die Reaktion spontan vom sx in Richtung zum dx führt.
DG > 0 , welches die Reaktion spontan vom dx in Richtung zum sx führt.
In diesem letzten Fall sieht eine etwaige Berechnung der wharves vorher, daß die wharves, die sie betreffend die Situation vermindern, sie sind die der Mitglieder anfangen, die zum dx in der Reaktion sich finden, während die Mitglieder zum sx das n° von wharves erhöhen.
30) in den equilibriums, in denen Gase Körper und erscheinen, den es der Wert der wharves vom festen ist:
Die wharves vom festen, die verbraucht werden, sind im genauen stöchiometrischen Verhältnis zu den Werten der wharves, die verursacht werden, das muß, aber, durch die Gleichgewichtskonstanten erreicht zu werden. Als Beispiel in der Berechnung der wharves zählt für die kc, sie gehen betrachtete nur die wharves der Gase zusammen.
31) wie sie beeinflußten die equilibriums der festen Systeme und der Flüssigkeiten von den Änderungen des Drucks oder der Temperatur kommen:
Der Druck wirkt Minimum in, wieviel in diesen Reaktionen die Volumenveränderungen unzulänglich ist.
32) als ein sein kann velocizzare Reaktion:
Wenn es umschaltbares Muß selbst ist, seien den Reaktion Produkten als Formen selbst, in solch einer Weise entfernt Sie, die der Prozeß in der Weise durchführt fast geschieht.
33) während sie es kommen, beeinflussen die heterogenen equilibriums zu Ihnen von den Temperatur- oder Druckschwankungen:
Es gibt Reaktionen, für die seiend anwesende Flüssigkeiten, Körper und Gas, es sofortig ist, zu verstehen in welcher Richtung die Reaktion mit Volumenzunahme durchgeführt wird, die Reaktion sich dreht heraus angeregt in solcher Richtung, wenn der externe Druck vermindert.
Es ist intuitivo als Beispiel, zum zu denken, daß, wenn der Druck erhöht wird, die Ordnenreaktion versucht, seinen Druck zu vermindern und folglich das Gleichgewicht verschobenes damit sfavorire die Gaskreation betreffend ist feste Flüssigkeiten ist oder.
34) daß particularitity equilibrio das NH 4HS(S)" NH 3(S) H 2S(G)hat
Das Reagens wird zum Festkörper folglich erscheint nicht irgendwelche in K Cgefunden, das in KP kein in irgendeiner etwaiger Berechnung der wharves durch PV = n Funktelegraphie, die es nur Richtung für die Mitglieder zum gasförmigen Zustand hat.
35) für das Gleichgewicht SnO2 können 2H 2(G) "Sn (S) 22Hoder (g) als 5 wharves Sn erreicht werden:
Berühmtes 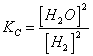 muß ja gebildet werden,
daß [ H2 ] so ist, daß die
wharves von H2 10 sind, das die
doppelte Quantität der wharves von Teich ist.
muß ja gebildet werden,
daß [ H2 ] so ist, daß die
wharves von H2 10 sind, das die
doppelte Quantität der wharves von Teich ist.
36) für das Gleichgewicht C(S) Hoder2(g) " Co(G) H2 (g), wieviel Wasser zu mir für gasare 1.1 wharves von C (S) notwendigist :
1.1 wharves Co und 1.1 wharves von oder 2 müssen verursacht werden , damit das dve desumere die wharves dem Gleichgewicht vom K Pund diesen geschieht, zum 1.1 zu addieren.
37) warum, wenn lasci das Mineralwasser dieses sgasa öffnete:
Wenn die Flasche Schleuse ist, gibt es von Co2 zwischen Wasser und Stopper, der einen festgestellten Druck hat, wenn wir die Flasche, diese Co 2Ausgänge öffnen und der Druck, zu dem sie unterstellt ist, die Lösung viel am niedrigsten der ist, folglich Co 2unter Form von bollicine, die oben in Oberfläche gehen, im nichtigen Versuch vom Teil der Lösung wird produziert, um auf diese Veränderung der System Enden folglich zu beantworten, daß nel.giro.di 10 das Wasser sgasa vollständig minuteren.